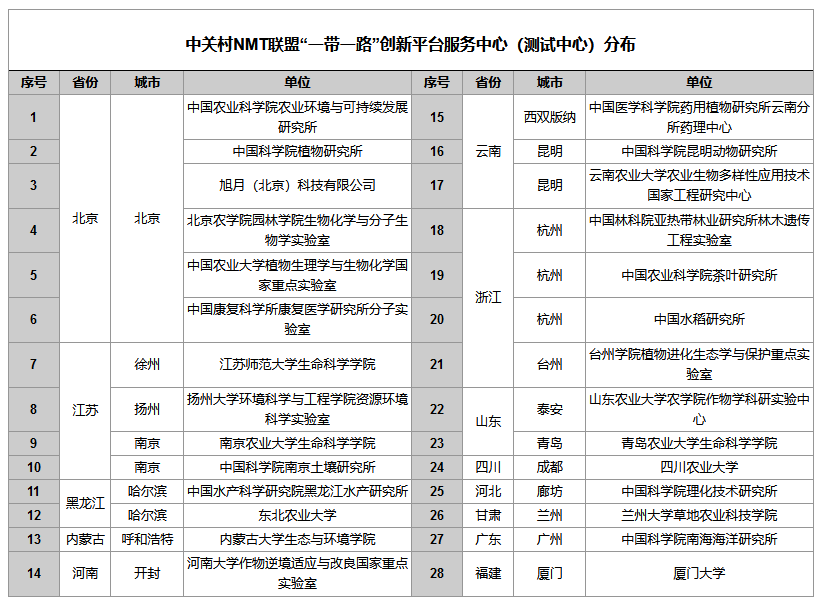
植物营养研究NMT标准化方案
植物营养研究NMT标准化方案
一、视频资源
二、参考文献
C2019-031,张亚丽,南京农业大学农业部作物遗传与种质创新国家重点实验室,PLANT PHYSIOL,NO3-
A Transcription Factor, OsMADS57, Regulates Long-distance Nitrate Transport and Root Elongation
C2019-004,陈少良,北京林业大学,New Phytol,杨树,根(距离根尖300-400μm),NO3-
Amelioration of nitrate uptake under salt stress by ectomycorrhiza with and without a Hartig net
C2018-020,张振华,湖南农业大学,Plant Physiol,拟南芥,NH4+、NO3-
NRT1.1-related NH4+ toxicity is associated with balance between NH4+ uptake and assimilation
C2019-032,张振华,湖南农业大学,plant sci,Cd2+、NO3-
C2019-029,李衍素、于贤昌,中国农业科学院蔬菜与花卉研究所,BMC Plant Biol,根毛区NO3-、NH4+
C2018-045,杨兴洪,山东农业大学,Front Plant Sci,番茄,根部伸长区,H+
C2018-040,施卫明、李光杰,中科院南京土壤所,Tree Physiol,红柳、棉花,根部(距离根尖5mm,20mm),NO3-
C2018-029,张佳宝,中国科学院土壤研究所土壤与可持续农业国家重点实验室,Front Plant Sci ,小麦,K+、O2
Potential Root Foraging Strategy of Wheat (Triticum aestivum L.) for Potassium Heterogeneity
C2017-032,王毅,中国农业大学,Plant Cell,爪蟾卵母细胞,K+/H+
C2017-010,许卫锋/张建华,福建农林大学/香港中文大学,J EXP BOT,根,H+
C2016-004,张振华,湖南农业大学,Plant Physiology,液泡,NO3-
C2015-036,童依平,中科院遗传发育所,Plant Physiology,根,NO3-
C2015-007,童依平,中科院遗传与发育生物学研究所,Plant Physiology,根,NO3-
C2014-022,余玲,南京农业大学,Plant Physiology,根,K+
C2013-020,罗志斌,西北农林科技大学,J EXP BOT,根,NH4+/NO3-/H+
C2013-008,夏新莉/尹伟伦,北京林业大学,PLANT CELL ENVIRON ,根,NO3-
C2012-021,徐国华,南京农业大学,Plant Physiology,根,NO3-
C2012-006,施卫明/张建华,中科院南京土壤研究所,PLANT CELL ENVIRON ,根,H+
C2010-006,施卫明,中科院南京土壤研究所,PLANT CELL ENVIRON ,根,NH4+
三、常测哪些指标
NO3-、NH4+、K+、Ca2+、H+
四、检测这些离子流、分子流,有什么生物学意义
-
2)科研案例
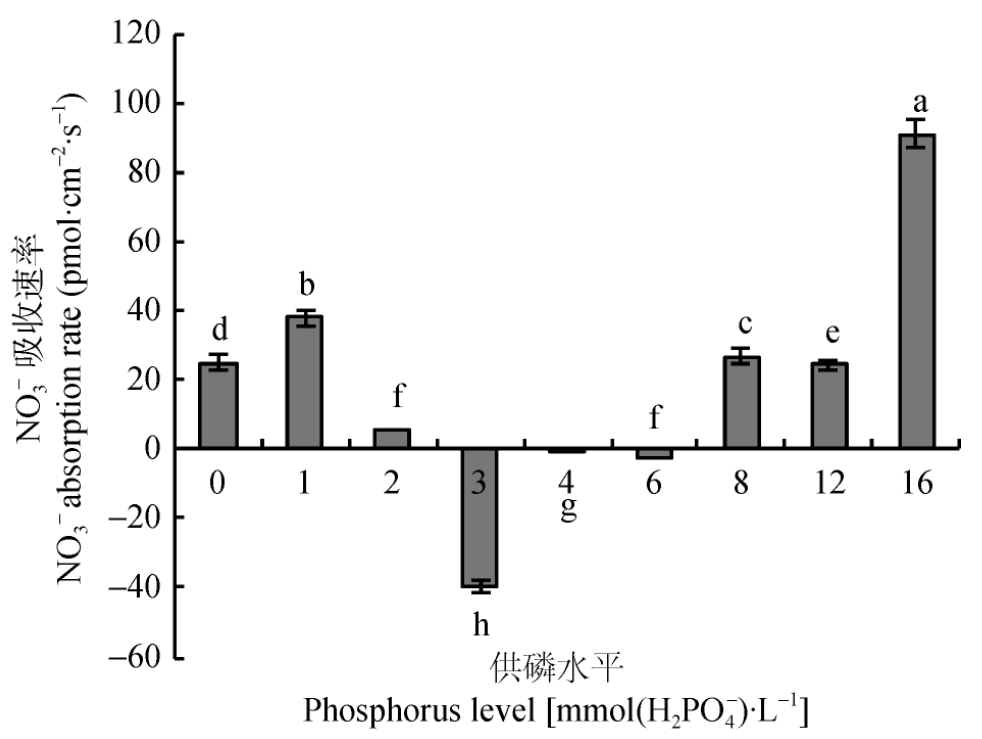
运用15N示踪及非损伤微测技术,研究了不同供磷水平对平邑甜茶幼苗NO3--N吸收及利用特性的影响,当生长介质磷浓度在3.0~6.0 mmol×L-1时,平邑甜茶对NO3-有吸收作用,并在3.0 mmol/L磷浓度时其吸收速率最高。而在0~2 mmol/L及8.0~16.0 mmol/L磷浓度处理下,平邑甜茶对NO3-有外排作用,结合酶活、生物量等指标的测定,结果得出:磷浓度在3.0~4.0 mmol/L时最有利于平邑甜茶幼苗的生长及氮素的吸收利用。(彭玲,朱占玲,陈倩,季萌萌,陈汝,葛顺峰,姜远茂.供磷水平对平邑甜茶幼苗NO3-吸收、利用特性的影响.中国生态农业学报,2017,25(08):1147-1153.)
-
2)科研案例
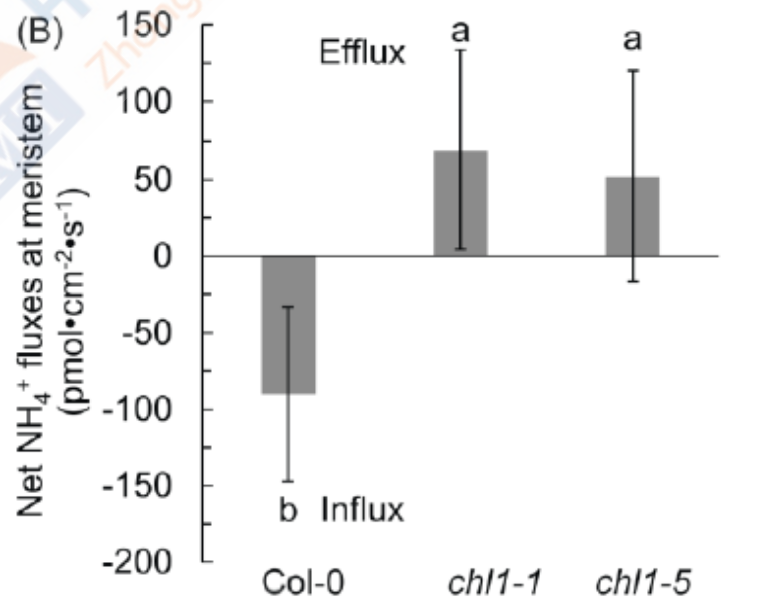
油菜nrt1.1突变体根部排 NH4+速率显著高于野生型。在 (NH4)2SO4环境下,NRT1.1 通过信号调控诱导油菜根中NH4+吸收转运蛋白的表达来增强对生长环境中NH4+的吸收;nrt1.1根中NH4+吸收转运蛋白没有受到(NH4)2SO4的显著诱导。此次研究成果,揭示了拟南芥 NRT1.1的信号功能调控铵吸收和C-N代谢解偶联,增强植物对铵胁迫的敏感性。研究结果为深入了解植物铵毒害的发生机制,提高稻田渍害条件下的油菜氮素养分利用效率提供了理论支撑。(Jian S, Liao Q, Song H, et al. NRT1.1-Related NH4+ Toxicity Is Associated with a Disturbed Balance between NH4+ Uptake and Assimilation. Plant Physiol. 2018;178(4):1473-1488. doi:10.1104/pp.18.00410)
-
1)K⁺生理功能概述
2)科研案例
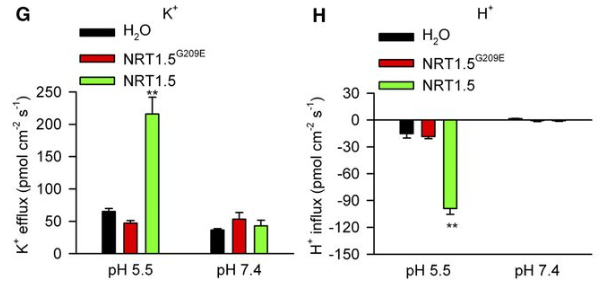
以拟南芥突变体 lks2为研究对象得到对应的转运蛋白基因 NRT1.5/NPF7.3,将其转入非洲爪蟾卵母细胞,检测了活体爪蟾卵母细胞 K+、H+流的变化过程。结果显示: lks2/nrt1.5突变体,特别是低钾条件下,在 K+、NO3-从根部转运至地上部分的过程中明显有缺陷,揭示了NRT1.5在 K+从根部转运到地上部过程中起到的重要作用,同时也参与了 K+/NO3-分布的协调过程。(Li H, Yu M, Du XQ, et al. NRT1.5/NPF7.3 Functions as a Proton-Coupled H+/K+ Antiporter for K+ Loading into the Xylem in Arabidopsis. Plant Cell. 2017;29(8):2016-2026. doi:10.1105/tpc.16.00972)
-
2)科研案例
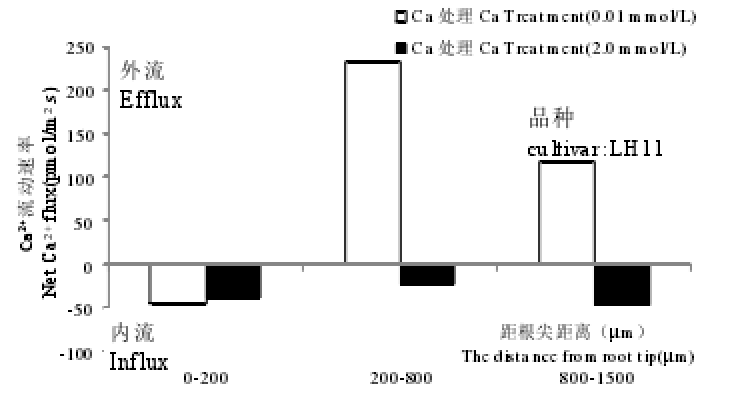
缺钙胁迫的花生LH11根系上,距根尖200~800 µm和200~1500 µm处,Ca2+离子流主要为外流特征,而YZ9102根系仍保持一个稳定的Ca2+内流。正常供Ca条件下,品种LH11,距根尖1500 µm处Ca2+表现为内流,YZ9102在距根尖200~1500 µm区域表现为Ca2+内流,距根尖200 µm处表现出Ca2+外流。结合形态观察和亚细胞定位等结果发现,花生品种LH11较YZ9102对缺Ca更为敏感,缺Ca胁迫下,YZ9102保持良好的根系形态和细胞结构,有较强的Ca2+吸收能力,Ca2+由根部向地上部运输较多,这些可能是花生YZ9102更耐缺Ca的一些重要原因。(高丽丽. 两个花生品种苗期钙素营养特性比较.中国农业科学院,2013.)
-
1)H⁺生理功能概述
2)科研案例
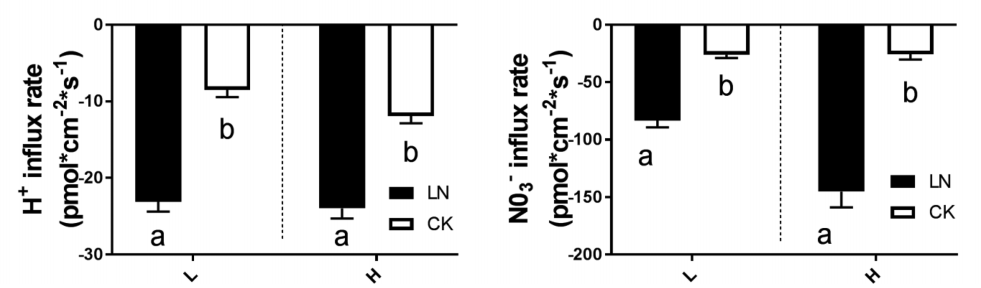
课题组利用高NUE甘蓝型油菜基因型H,低NUE甘蓝型油菜基因型L和拟南芥突变型AUX1三种类型样品,阐释不同施 N 量下 NUE 变化的机制。LN条件下,甘蓝型油菜的NUE增加,通过调该研究检测样品根尖NO3-和H+吸收速率,发现LN条件下,二者的吸收速率显著增加,结合光合和基因表达等实验结果,说明通过改变RSA、相关基因表达、根系质膜 H+-ATPase 活性和根系活力, LN胁迫促进了根系对N的吸收能力。这个过程可能受到IAA分布的影响。 该研究结果为植物适应环境机制研究提供了新的方向。(Wu Z, Luo J, Han Y, Hua Y, Guan C, Zhang Z. Low Nitrogen Enhances Nitrogen Use Efficiency by Triggering NO3- Uptake and Its Long-Distance Translocation. J Agric Food Chem. 2019;67(24):6736-6747. doi:10.1021/acs.jafc.9b02491)
五、可以检测哪些样品
1、动物样品
1)细胞
神经细胞、肿瘤细胞、巨噬细胞、淋巴细胞等
2)组织器官
肿瘤、皮肤、胃粘膜、胰岛、脑(海马体等)、胚胎(大鼠、鱼)、斑马鱼皮肤/鳃、耳蜗、心脏(香螺)、卵(鱼、鸡蛋、爪蟾)、骨骼、角膜、脊椎(豚鼠)、肌肉组织(肌纤维、心肌)
3)其它动物样品
珊瑚、螨虫、昆虫(果蝇幼虫的肠、蟑螂血脑屏障、按蚊、长红锥蝽)、蝌蚪、水蛭、蓝蟹(微感毛)、变形虫、水丝蚓
2、植物样品
1)营养器官
茎:边材、心材、微管形成层、木质部
2)生殖器官
花:花瓣、花瓣表皮细胞、花粉
种子:整体、胚
果实:果壳、果皮、果肉(苹果、柑橘)、籽粒、棉花纤维、棉桃
3)细胞:植物悬浮细胞、液泡
4)愈伤组织
3、微生物样品
酵母细胞、菌丝、菌落、微藻、细菌(大肠杆菌)
4、其它生物样品
周丛生物
5、非生物样品
金属、混凝土、泥沙、纳米材料、生物医药材料
六、样品需要做哪些前处理
国际领先的非损伤微测技术最大的特点就是活体、无损检测,因此动植物材料在检测前,不需要任何的液氮速冻、染色、研磨处理等。
1、动物单细胞
因NMT是活体检测,故从培养箱中拿出来后,置于培养皿中,直接检测即可。
2、动物组织
因NMT是活体检测,无需提前处理。如检测部位天然暴露在外,如斑马鱼皮肤离子细胞、侧线毛细胞,直接检测即可。如检测部位位于体内,需在检测时暴露出检测部位(可采用麻醉的方式),后检测即可。
3、植物根茎叶等组织器官
天然暴露在外的组织器官,例如根、茎、叶的表面,无需任何处理,直接检测即可。水培、土培、砂培、平板培养均可。
4、植物原生质体/液泡
因NMT是基于微传感器/探针的非损伤检测,检测时不接触样品,故原生质体、液泡需要从组织或者细胞中,提取出来后检测。
5、植物叶片的表皮细胞、叶肉细胞、盐腺细胞、保卫细胞
无需提前处理。因这些细胞处于组织内部,故检测时采用撕取等方式,暴露出相应细胞即可。
6、植物花粉管
离体萌发:在培养皿中萌发一段时间后即可直接检测;在体萌发:将柱头置于培养皿中,待萌发一段时间后即可直接检测。
7、植物果实
无需提前处理。如待测部位位于果实内部,需在检测前暴露出相应部位即可。
8、植物悬浮细胞
无需提前处理。检测时,置于培养皿中检测即可。
七、有哪些检测方式?
即瞬时处理,是指在检测过程中,在正常测试液中瞬间加入所需的干旱胁迫溶液(PEG或甘露醇等溶液)的处理方法,目的是为了观察瞬间干旱胁迫下,样品短时间内的离子/分子的变化趋势,即短时效应。
2、预处理/提前处理好后检测
是指在干旱胁迫一段较长的时间后(数十分钟/数小时/数天),观察植物离子/分子进出的情况,即长时效应。
八、检测环境是空气还是溶液
检测时,只要求待测部位浸于溶液中(无需整体都浸在溶液里)。
九、样品是如何检测的
十、可以送样检测吗
可以送样检测。目前非损伤微测技术测试服务由中关村NMT产业联盟统筹管理,由遍布全国的25家NMT创新平台服务中心,提供检测服务。点击获取测试服务