NMT实验设计
NMT实验设计
NMT实验基本知识
NMT可测离子/分子
非损伤微测技术测定的指标是离子和小分子的流速,包括离子和小分子流动的大小和流动的方向,具有时间性和空间性。即获得的数据是离子和小分子的流动随着时间的大小变化和空间变化。
- 非损伤微测技术目前成熟测定的离子有:Pb2+、Ca2+、H+、Na+、K+、Cl-、Mg2+、Cd2+、NH4+和NO3-。
- 小分子有:IAA、O2和H2O2。
- 更多的离子和小分子的测定在进一步开发中,如NO、Glucose、Zn2+、Fe3+等。
- 非损伤微测技术获得的指标流速的单位是:10-12 mol • cm-2 • s-1。
获得的离子的流速可以是来自离子通道的,也可以是转运体或者质子泵等离子泵。因此使用非损伤微测技术可以研究离子通道,转运体,膜蛋白的功能,H+-ATPase等的活性。
NMT测试方法(动画)
- 测试步骤:
- 准备活体材料-->将材料放置到载物台上-->电极进行测量,即可看到其生理变化
- 请点击查看以下动画:
NMT测试得到的信息
- 什么是流速(flux)?
- 1.广义的流速
- 流速是指物质在介质和空间中运动的速度,具有方向性和时间性。
- 2.狭义的流速
- 流速是指生物体由于内外交换形成的离子和小分子梯度中离子和小分子的运动速度。
- 注:这里的流速是指生命科学中的流速(flux)。
- 流速的意义是什么?
- 1.流速是活细胞的语言
- 流速是活细胞信号转导过程的直观反映,是活细胞的语言。
- 2.流速是信号转导/功能的桥梁
- 流速是基因发挥功能的桥梁,基因表达的指令通过物质的流动进行传递。
- 3.流速是活体生命的本质特征
- 流速是活体生命的本质特征。
流速概念的引入,推动了生命科学研究从传统的大量前处理实验进入简便的活体和动态测量时期,测定流速的工具非损伤微测技术与活体成像技术成为这一时期最为突出的两项技术。由于活体测量和活体研究,极大地改变了人类对生命活动的认识。
实验中的典型数据示例
NMT测试数据可以通过流速图以比较直观的方式呈现,这是NMT技术相较于其他技术的一大优势。在实验过程中能够很直观地看到实验数据,如果在测试过程中发现有什么问题可以及时对实验进行调整。
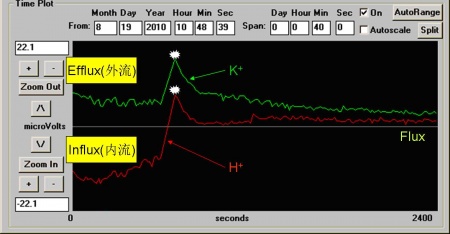
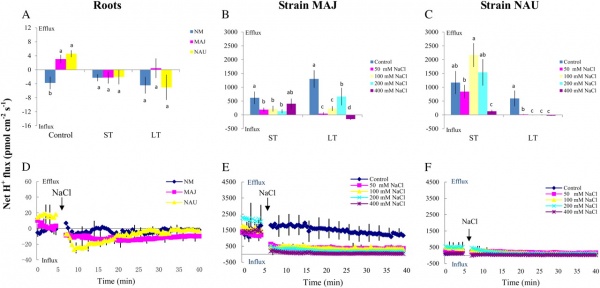
下图所示为通过NMT技术双电极同时测定植物根的K+和H+的流速,通常我们的实验为单电极,则下图中只有一种离子的流速变化趋势。
图中,红色的线代表H+流速,绿色的线代表K+流速。所记录的数据,纵坐标为样品离子的流速或者是距样品两点间的电压差ΔV(μV),横坐标为记录的时间。测试离子为阳离子时。在零线上方(正值)的曲线是指离子外流(Efflux),零线下方的曲线是指离子内流(Influx),阴离子则零线上下代表的趋势与之相反。白色点是指进行了一个刺激处理,当受到刺激处理后,测试样品的H+和K+的外流增加。
NMT实验测得的流速跟胞内离子浓度变化的关系
某一离子进入胞内是否导致胞内离子浓度升高,或者是离子流出细胞是否导致胞内离子降低。这种问题没有确定的或者一一对应的关系,因为离子的进出非常复杂,而且细胞内具有不同的细胞器,不同的细胞器对离子的控制不同,因此导致离子出现动态平衡,而不仅仅是通过离子浓度梯度进行转运。
- 下面以Ca2+为例进行解释
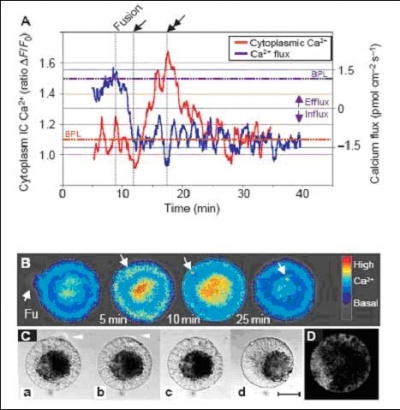
如果Ca2+进入细胞,可能导致胞内的游离Ca2+浓度升高,但是不完全确定,需要胞内的实验进行验证,如2001年Nature Cell Biology上的研究工作,用Confocal测定到胞内游离Ca2+浓度升高,同时用非损伤微测技术测到Ca2+内流(见图1和参考文献1)。但是我们用非损伤微测技术一旦测到Ca2+内流,则可以说胞外的Ca2+浓度下降,或者是测到Ca2+外流,胞外的Ca2+浓度升高。因为胞外的环境是可控制的,而且我们一般使用的测试液是无机盐,基本不存在缓冲作用。
如果Ca2+流出细胞,即Ca2+外流,也不能说明胞内的Ca2+浓度下降,有可能胞内的Ca2+库释放Ca2+,补充胞质中的游离Ca2+,也可以用Confocal进行验证。
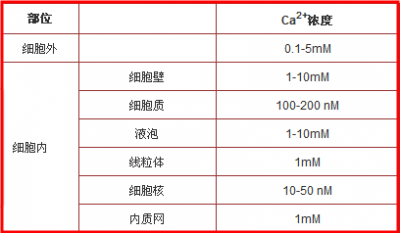
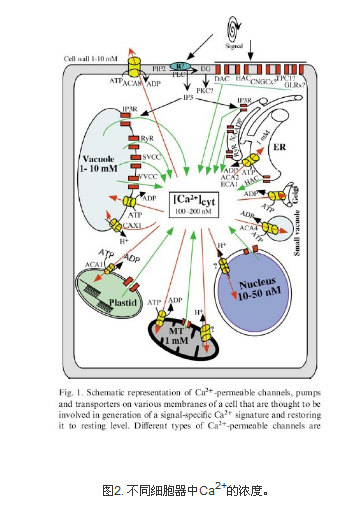
表1. 细胞内外Ca2+的浓度(来自于图2)
在正常生理状态下,细胞膜内外钙浓度相差高达1万倍左右。维持如此大的浓度梯度,主要靠细胞膜对Ca2+极低的通透性、钙亲合蛋白的缓冲以及依赖质膜两侧钙泵,Na+-Ca2+交换系统将Ca2+2+主动排除,或通过细胞内Ca2+库摄取于贮存Ca2+。由于细胞膜的存在,以及细胞膜上离子通道/转运体的存在,导致膜内外的离子浓度有很大差异,这也是造成主动运输的结果。
- 参考文献:
- 1. Antoine AF, et al. Nature Cell Biology, 2001, 3: 1120 – 1123.
- 2. Reddy VS and Reddy ASN. Phytochemistry, 2004, 65: 1745 – 1776.
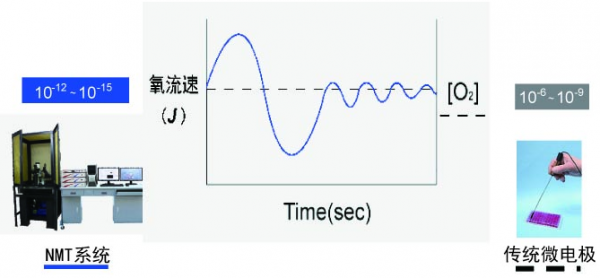
NMT与微电极技术对比
| NMT技术 | 微电极技术 | |
|---|---|---|
| 检测方式 | 活体,原位,非损伤 | 离体 |
| 检测环境 | 贴近生理环境 | 脱离生理环境 |
| 空间分辨率 | 0.5um;2um | 需要一定量的溶液 |
| 获得的信息 | 净流速(大小和方向) | 浓度(无方向信息 |
| 灵敏度 | 10-12~-15 | 10-6~-9 |
| 对样品的要求 | 从细胞器到生物整体均可 | 匀浆 |
| 样品是否需要提取 | 不需要 | 需要 |
| 检测环境 | 活体检测 | 脱离生物环境检测 |
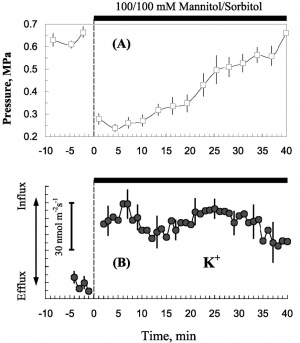
上图中可以直观的看出NMT系统和传统微电极测定仪器的优势及区别。NMT系统可以获得动态的生理变化的过程曲线(蓝线),而浓度测定设备测到的是无任何变化的直线(灰线),错过了生命科学家最为关心的很多重要生理过程。
我们再看一个实际科研的例子,下面这幅图是发表在Nature: Cell Biology上的一篇文章里。说的是玉米的配子和卵细胞融合后所引起的外源钙离子内流的现象。这个生理过程最显著的变化只持续了大约10分钟左右的时间,引起的钙离子浓度变化微乎其微,传统的静态电极技术在这里恐怕束手无策,望尘莫及。
实时获取进入玉米卵细胞的Ca2+流,当细胞融合时发生Ca2+内流。(Antoine AF, et al. Nature Cell Biology, 2001, 3: 1120 – 1123.)
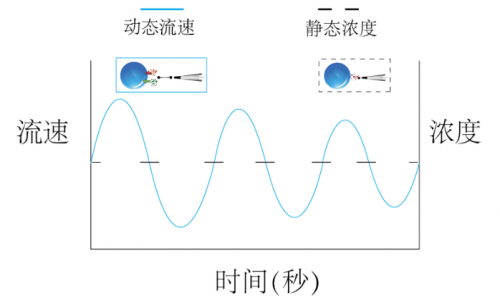
最后,还有很重要的一点就是,“静态浓度是动态流速的历史记录”,或者说被测生物外某一点的离子分子静态浓度,既可以是该离子分子内流的结果,也可以是被测生物外排导致的,而这一进一出在对于我们生命科学研究人员来讲,具有迥然不同的生理意义。因此,利用NMT技术获取动态分子离子流速信息,才有可能获得传统微电极技术难以得到的,准确的,活体的生命信息。
实际测试样品图片
NMT测试时需要先将样品在显微镜下找到,根据样品的大小选择合适的放大倍数,然后将样品的待测部位调节清楚,再将电极定位在待测部位处即可。此时可以利用NMT测试系统对样品和电极的状态进行截图,下面列举一些NMT实验中拍下的样品和电极的图片。
图一:植物根测试样品图
图二:植物根毛测试样品图
图三:植物花粉测试样品图
图四:植物纤维细胞测试样品图
图五:植物保卫细胞测试样品图
图六:动物细胞双电极测试样品图
图七:动物组织测试样品图
NMT测试过程中电极校正的意义和相关注意事项
NMT测试中的电极校正指的是:将电极放入已知离子浓度(不同浓度,2个或3个)的溶液中读取电压值,以Nernst方程为基础,建立浓度和电压的关系。
校正的目的主要有两个:1. 建立浓度和电压的关系,用于流速的计算。2. 保证测量结果的准确性。
正常情况下电极在一次测试中最少需要校正2次,即测试开始前一次,结束时一次。若在测试过程中发现电极背景电位变化过大,一价离子背景电位变化超过±10mV,二价离子背景电位变化超过±5mV时,为了确保电极的工作状态建议对电极进行再次校正。
离子的校正斜率范围:
- 一价阳离子的斜率范围是:58±5mV/decade;
- 一价阴离子的斜率范围是:-58±5mV/decade;
- 二价阳离子的斜率范围是:29±3mV/decade。
实验设计
测定离子/分子的选取
- NMT实验中需要选择最相关、最有规律的离子和分子作为检测的指标。
- 对于初次接触NMT技术的人员,以下的测试经验可供参考。
- (1)研究盐(NaCl)胁迫测定Na+、Cl-、K+、Ca2+、H+
- (2)研究植物氮营养测定NH4+、NO3-、H+
- (3)研究植物钾营养测定K+
- (4)研究细胞凋亡测定K+和Ca2+
- (5)研究植物干旱胁迫测定K+
- (6)研究特定的离子通道则直接测定该离子
- (7)研究离子转运体则直接测定涉及到的两种离子
- (8)研究呼吸或者线粒体代谢测定O2和H+
- (9)研究光合作用测定O2和H+
- (10)研究重金属Cd2+的吸收直接测定Cd2+或者H+
- (11)研究信号转导测定Ca2+
- (12)研究和Mg2+相关的酶活性或者Mg2+吸收直接测定Mg2+
- (13)研究阴离子的作用直接测定Cl-
- (14)研究细胞极性生长测定Ca2+或者H+
- (15)研究骨骼、贝壳、珍珠的发育直接测定Ca2+的吸收
- (16)研究植物的缺氧测定K+和O2
- (17)研究植物耐水淹机理测定H+
- (18)检测细胞活性测定O2或者H+、K+、Ca2+
- (19)菌根化的研究测定Ca2+或者H+
测试样品的培养及注意事项
样品培养是NMT实验的关键,样品培养的情况会直接影响到实验结果和数据的重复性。培养周期要相对固定,培养液成分要保持一致。
1.以检测植物根部为例。由于测试过程是在液体环境中,样品的最理想培养条件为水培或者是土培后再进行水培发根。这样培养的样品表面干净,表面附着的物质可以通过在测试液中平衡处理去除,保证测试数据的稳定性和准确行。此外如果想测定根毛区,但是培养的样品根毛并不是很多,可以向培养液中充气,促进植物根毛的生长。
2.在准备样品时应尽量多准备一些样品,以便于在实验过程中选取形态比较一致的材料进行实验,避免测试过程中使用状态不好的样品。只有保证了实验材料的一致性才能更好地保证实验数据的一致性。
3.此外,对于研究植物营养方面的实验,若想观察实验材料对某种离子流的吸收情况,最好在测试前对样品进行饥饿处理,饥饿处理的时间至少24小时,可根据不同实验材料的情况制定具体的饥饿处理时间。
测试液和校正液的准备原则
- 测试液是指测试时样品所处的液体环境。
校正液是指用来校正电极的溶液,原则上尽量和测试液相似,高浓度校正液和低浓度校正液的待测离子浓度范围应该包含测试液中待测离子的浓度,高低校正液浓度一般相差10 倍(一些分子除外)。
- 注意:测试液中的离子浓度是指溶液所有成分中同一种离子的浓度总和。
测试液和校正液pH 的调节需注意,不能用含有待测离子的酸或碱调节,如测定Na+ 时调节pH 值不能用NaOH,否则就使溶液中的Na+含量增加,可用较少量的KOH 调节,最好用氯化胆碱或Tris。
- 测试液和校正液配方设计需要遵循的原则:
- (1)测试液尽量和样品的培养液一致,使样品保持自身的活性。
- (2)测定的离子含量在测试液中不宜过高,尽量维持一个较低的水平。
- (3)测试液中应该含有所测定的离子(特殊的研究,如先用没有所测定离子的溶液,然后再加入此种离子的实验情况除外)。
- (4)测试液尽量维持一定的渗透压和pH值,以保证样品的活性。
- (5)不同的校正液之间的浓度一般相差10 倍(特殊的分子除外)。
(6)测试液和校正液最好用相应成分的母液(例如:100 倍的母液)稀释进行配制,避免直接称量误差较大,导致浓度不准确,影响校正和测试。
严格讲所有溶液均需灭菌,特别是当溶液中含有糖类等容易滋生细菌的物质时,不灭菌会对测试结果产生影响。但为了实验的方便,当溶液中仅含无机盐且被测样品对细菌不是非常敏感时,可不做灭菌处理。
NMT实验的其它注意事项
- 样品:在实验中保持活性,未受到明显的损伤。
样品的大小最好在5µm至40cm的范围内。
结构合适,便于观察和操作,易于固定。
- 测试时如何选择样品:选择性状相似的样品,以保证样品状态的一致性。
- 测定部位:精确到微米。不同部位离子流差异较大,选择样品的同一点进行测定。可以先做扫点实验。
- 处理:处理具有明显的现象,瞬时处理不影响测定体系,如有影响,则进行预处理。
- 测定的离子和分子:选择最相关,最有规律的指标。是否需要研究两个指标的相关性(双电极)。
- 测试液:测试液保证样品的活性,能够测得待测物质的信号,且体系稳定;简单、适合,获得的离子流稳定;按照样品大小和
数量配制,用量不大。
- 校正液:一般设置两种,成分除待测离子之外,和测试液相同。且两种溶液的待测离子浓度包含测试液中的待测离子浓度。
- 对照的设置:通过设置对照,使结果受到的影响因素单一化。样品周围和背景的对照。
- 重复:建议做6个或6个以上重复(有效重复),6个重复是一个基本的小样本。
- 时间:一般以获得稳定的离子流数据为准。3min(柱状图)~15min(动态图)。
- 培养皿:一定要使用薄底的塑料培养皿,透光好,折光均匀,易定位。
- 安全性:是否有危害人体和环境的物质、操作等。
常见样品的固定方法
植物根(请点击)
植物保卫细胞(请点击)
体视镜检测样品(请点击)
原生质体及悬浮细胞(请点击)
植物种子与类似形状的样品(请点击)
米粒等小样品(请点击)
数据处理及文章撰写
数据处理方法及教程
流速换算表及教程下载
- 1. NMT流速换算表(JCal) V3.2版
将离子流速、分子流速、IAA流速、膜电位、双电极(离子/离子)流速、双电极(离子/分子)流速6个表格整合在一起,供旭月公司客户免费使用。
- 目前最新版本为V3.2
- 更新日期:2013-02-28
- 2. NMT流速换算表(JCal) V3.2版教程
- 针对上述6种换算表格进行图文说明,供旭月公司客户学习使用。
- 目前最新版本为V3.2
- 更新日期:2013-02-28
Excel数据分析和做图教程
- 使用Excel可以非常方便地实现大多数情况下的数据分析和做图,教程如下:
Excel给数据图加上ERROR BAR
大家在使用各种软件进行数据处理和做图时,需要给结果加上误差线,目前常用的是标准偏差,又叫标准误,简写为SD,那么如何使用Excel给数据图加上ERROR BAR呢?请看附件中的内容,可以使用excel轻松实现这种做图。
异常点去除
测试过程中可能会突然出现一个或几个异常的数据点,出现异常数据点的原因有很多,例如像大型仪器开启,有时候室内电灯的开关也会对正在测试的系统产生影响,非损伤系统对电信号是十分灵敏的。但是这样的问题在测试过程中也不会经常出现,如果在测试过程中出现了由于干扰产生的异常数据点,在处理数据时将异常数据点直接删除即可。
快速寻找标记
- 具体步骤:
- 1. 使用Excel打开txt数据文件,点击Ctrl+F,然后输入查找内容为“LogEntry”。
- 2. 继续点击查找下一个,然后更改其填充颜色为红色(或者别的醒目的颜色也可以),双击格式刷键。
- 3. 点击对话框中的查找全部,然后点击Ctrl+A,最后关闭对话框,并且单击格式刷。
- 经过以上的操作,所有的样品标记单元格就都变成了特殊的填充颜色,可以在查看数据时方便快捷的找到样品标记。
换算得到的流速正负代表的含义
- 查看不同的参考文献时会发现流速的正负值所代表的含义是存在差异的,如下面两幅图所示。
- 非损伤微测技术在国内外均有应用,其原理都是一样的,但是在系统软件上设定的会有所不同。
- 假设靠近样品的电位为V0,远离样品的电位为V1。
有些系统的软件中是以V0-V1得到电压差,而有些系统中的软件中却是以V1-V0得到电压差,所以测同一个样品得到的正负值应该是相反的,计算之后就会出现,有些文章中正值为外排,有些文章中正值为吸收的趋势。主要是由于不同系统软件中的电位差值得到的方法不一样。
- 使用旭月公司提供的非损伤微测系统所测得的流速正值为外排,负值为吸收。